再生医療等製品の品質保証についての雑感【第30回】

今回も引き続き、工程設計について雑感を述べる。
QbDを意識した工程設計の考え方 (2) ~ 上流工程その1
はじめに
今回も引き続き、工程設計について雑感を述べます。上流工程は、原料となる細胞が基本的に有する能力より、増幅プロセスと分化誘導プロセスに分類できます。増幅プロセスは従来の製薬でも活用される培養技術ですが、必ずしも同様に実施できるとは限りません。
● 原料となる細胞と培養について
いまさらですが、細胞加工製品の原料について再確認します。製品の品質要求では、含まれる細胞が治療の有効性を担保することが必達となるので、原料となる細胞はそれに相応したものを選択する必要があります。そのため原料となる細胞が、マウスCHO細胞等のセルラインのようにシングルセルで浮遊培養が可能であることや全量の培地交換を要しないなど、必ずしも培養プロセスの利便性に応じた機能を有するとは限りません。ドナーの体組織から単離した細胞(幹細胞を含む前駆細胞群)は、接着細胞であれば、培養操作において培地交換や継代の作業が不可欠であり、増殖可能な回数にも制限が生じます。
現状で細胞加工製品の原料として採用される細胞は、図(左)のように、ES/iPS細胞のような万能細胞、あるいは患者あるいはそれ以外のドナー由来で多能性の体性幹細胞あるいは前駆(寡能性)細胞を含む分化(組織)細胞に限られます。(※法令上は、多分化能を有する細胞を幹細胞と定義しています。)万能細胞は、理論上、無限の自己複製能(増幅能)と全ての細胞種への分化能を有し、比較的細胞数の確保も容易ですが、そのまま(未分化状態で)移植することはできません。他方、ドナー由来の体細胞は分化能が限定的で、そのまま治療に供することも可能ですが、採取できる細胞種が限られ、増幅能にも制限があるため大量に確保できません。また、万能細胞はマスターセルバンクを樹立することで製品のライフサイクルを通して同一の原料細胞が供給できますが、ドナー由来の体細胞は製造毎に原料の細胞特性に個体差が生じる可能性があります。
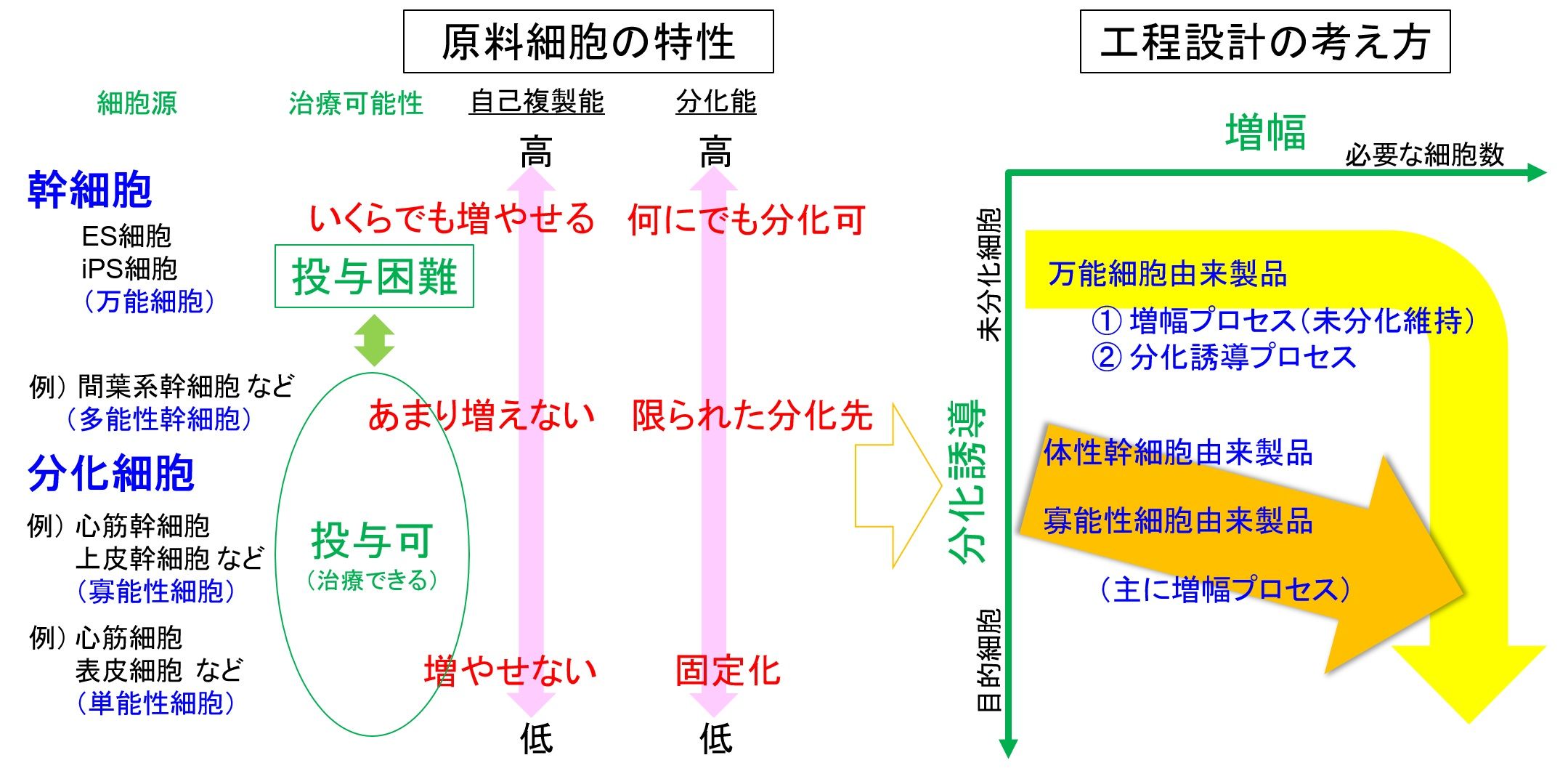
万能細胞を原料とした細胞加工製品製造の上流工程では、図(右)のように、原料細胞の未分化状態を維持したまま十分な量の細胞数を得るための増幅プロセスに続き、必ず目的の細胞に分化させる分化誘導プロセスが行われます。ドナー由来の体細胞を原料とした場合は、限定的な増幅能をできる限り維持できるように培養条件を整えた、増幅プロセスが主体の工程設計が構築されます。(万能細胞よりマスターセルバンクを有する多能性幹細胞原料が準備された場合の製造も後者の扱いになると考えます。)自己複製能が有限となるため、製品によっては、増幅プロセスの進行に合わせて適切に目的細胞に誘導する必要が生じます。
2ページ中 1ページ目













コメント
/
/
/
この記事へのコメントはありません。
コメント